
テーマ:電気安全
薬機法(旧薬事法)の改正ポイントについて紹介
2017年10月16日
電気ソリューション部 システム安全設計課の亘です
最近問合せが増えております、医療機器の電気的安全性についてご紹介します。
厚生労働省は医療機器について、産業振興のための政策に取り組み、国際競争力を強化することを推し進めています。
その政策の中で、従来の薬事法が、2014年に「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(通称、薬機法)に改正されて、医療機器の安全性に対する要求も強化されました。
薬機法の主な改正として2つのポイントを紹介いたします。
<医療機器の扱いとカテゴリー>
これまでの薬事法から「医療機器」の「章」が新たに追加され、クラス分類が下記のように改定されました。

従来と比較し、クラスⅢがPMDA(1機関)から第三者認証(14機関)に拡大されたことで、厚生労働省として増加する医療機器への対応を図りました。
これにより体外式結石破砕装置や汎用輸液ポンプといった医療機関で使用される機器はクラスⅢですので、これまで大臣承認だったものが登録認証機関による第三者認証に変更されるケースがあります。
電子式血圧計や電子体温計といった家電製品に近いような機器はクラスⅡですので、多くは登録認証機関による第三者認証になります。但し、クラスⅡでも、新規医療機器等は大臣承認になる場合もあるので注意が必要です。(クラスⅠやⅢも含む)
この分野の機器については、家電製品に近いこともあり、評価項目や水準のご相談を頂く機会が多いです。我々も、機器の特性を考慮し回答、ご提案をさせて頂いております。
<安全性の適合を確認する規格>
薬機法では安全性の適合を確認するため、JIS T 0601-1を満足することを要求しています。その対象であるJIS規格が2017年5月31日に「JIS T 0601-1:2017」に切り替えられました。(旧版であるJIS T 0601-1:1999は失効しました) 2017年度版では、特に感電に関する要求がこれまでより厳しくなりました。
一例を挙げますと、接地線が故障(断線)したことを想定した試験があります。
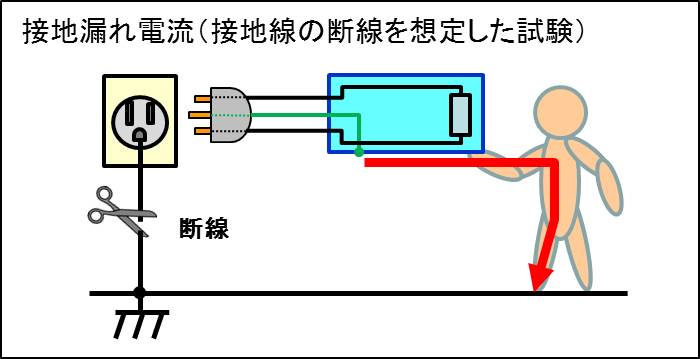
医療機器の開発では接地線を設けて感電に対する安全性を高めていると思います。
しかし、この接地線がトラブルにより断線したと想定した試験が追加され、その状況下でも感電してはならないと要求されています。(接地漏れ電流測定)
このように、トラブルを想定した試験が2017年版では多く追加されています。
弊社では、薬機法に対応すべく評価環境の整備を行い、JIS T 0601-1:2017 (電気的安全性)の評価ができるようになりました。
プロダクト解析センターの試験報告書は、各クラスにおける届出や第三者認証に必要な、エビデンスとして利用頂くことが可能です。
医療機器の安全性についての、ご相談、お困りのことがあれば、是非ご相談下さい。






